ΒΙΟΦΥΣΙΚΗ
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ
ΚΡΥΣΤΑΛΛΩΣΗ ΠΡΩΤΕΙΝΩΝ


Όταν ένα βιολογικό μόριο διαλυτοποιείται σ΄ έναν διαλύτη λαμβάνουν χώρα αλληλεπιδράσεις διαφόρων τύπων : ιοντικές-διπολικές, διπολικές-διπολικές, ιοντικές-ιοντικές και υδρογονικοί δεσμοί. Οι διαλύτες με βάση την διηλεκτρική τους σταθερά (ε) διαχωρίζονται σε διπολικούς και μη πολικούς ή απολικούς. Οι διπολικοί διαλύτες (ε>15) σχηματίζουν δίπολα μεταξύ ατόμων διαφορετικής ηλεκτραρνητικότητας (πχ C=O,C=Cl ) και αν τα μόρια τους φέρουν στην επιφάνειά τους εκτεθειμένα πρωτόνια (O-H, N-H) ονομάζονται πρωτικοί (νερό, φορμικό οξύ, μεθανόλη, αιθανόλη), διαφορετικά μη πρωτικοί ή απρωτικοί (ακετονιτρίλιο, ακετόνη). Οι απολικοί διαλύτες (ε<15) περιλαμβάνουν κυρίως υδρογονάνθρακες (βενζόλιο, n-εξάνιο). Οι ισχυροί ηλεκτρολύτες (πχ αλάτια) διίστανται πλήρως σε διπολικούς διαλύτες και διαλυτοποιούνται σε πολικούς διαλύτες με ιοντικές-πολικές αλληλεπιδράσεις. Οι ασθενείς ηλεκτρολύτες διίστανται μερικώς σε διπολικούς διαλύτες σε ποσοστό εξαρτώμενο από την φύση του διαλύτη (που προσδιορίζεται από την σταθερά διάστασης).
Σ΄ ένα υδατικό διάλυμα τα ιόντα της διαλελυμένης ουσίας αλληλεπιδρούν άμεσα με ιοντικές-πολικές δυνάμεις με τα μόρια του νερού , με αποτέλεσμα την δημιουργία της σφαίρας ενυδάτωσης ή σύμπλοκης σφαίρας. Κάθε ιόν διατάσσει γύρω του ορισμένο αριθμό μορίων νερού που δημιουργούν την πρώτη σφαίρα ενυδάτωσης, η οποία περιβάλλεται από μια δεύτερη σφαίρα λιγότερο οργανωμένη, την δεύτερη σφαίρα ενυδάτωσης. Τέλος, το νερό που περιβάλλει και τις δύο ονομάζεται άμορφο νερό (bulk water).
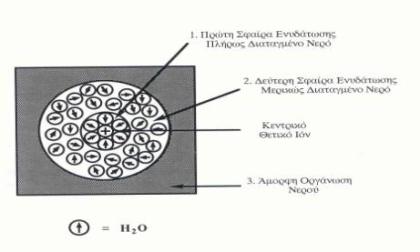
Εάν αυξηθεί η συγκέντρωση του ηλεκτρολύτη στο υδατικό διάλυμα τότε αυξάνεται και το ποσοστό των οργανωμένων μορίων νερού που βρίσκονται στις σφαίρες ενυδάτωσης με αποτέλεσμα την μείωση της πολωσιμότητας του διαλύματος άρα και της διηλεκτρικής του σταθεράς.
Τα βιομόρια σε υδατικά διαλύματα λειτουργούν σαν ηλεκτρολύτες, με αποτέλεσμα οι πολικές τους ομάδες να αλληλεπιδρούν μεταξύ τους, με μόρια νερού και με άλλα βιομόρια με δεσμούς υδρογόνου. Αντίθετα, οι φορτισμένες ομάδες τους προσανατολίζουν τα μόρια του νερού γύρω τους ακριβώς όπως τα ιόντα αλατιών ή αλληλεπιδρούν με άλλες φορτισμένες ομάδες ιδίων ή διαφορετικών μορίων.
Έτσι δημιουργείται γύρω από το βιομόριο μια πρώτη σφαίρα ενυδάτωσης ισχυρά διαταγμένων μορίων νερού, που περιβάλλεται από μια δεύτερη με λιγότερο διαταγμένα μόρια νερού. Εκτιμάται, ότι για κάθε αμινοξικό κατάλοιπο μιας πρωτεΐνης αντιστοιχεί περίπου ένα δεσμευμένο μόριο νερού.
Η θεωρία των Debye-Huckel αφορά στα ηλεκτρολυτικά διαλύματα και στηρίζεται στις ηλεκτροστατικές αλληλεπιδράσεις, όπου το ηλεκτρολυτικό διάλυμα γύρω από ένα ιόν περιγράφεται σαν μία κατανομή ενός νοητού νέφους αντίθετου φορτίου γύρω από το κεντρικό σημειακό φορτίο του ιόντος και η μεταβολή του χημικού δυναμικού μ ενός ηλεκτρολυτικού διαλύματος ως προς το ιδανικό δίνεται από τον τύπο
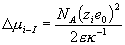
όπου ΝΑ ο αριθμός του Avogadro, zie0 το φορτίο του κεντρικού ιόντος, ε η διηλεκτρική σταθερά του μέσου και κ-1 η ακτίνα της ιοντικής ατμόσφαιρας με διαστάσεις μήκους. Έχει πειραματικά αποδειχθεί ότι η θεωρία των Debye-Huckel περιγράφει ικανοποιητικά μόνο τα αραιά ηλεκτρολυτικά διαλύματα (0 εως 0.001 Μ)
Η διαλυτότητα των βιομορίων σε υδατικά ηλεκτρολυτικά διαλύματα εξετάζεται σε σχέση με την συγκέντρωση των ηλεκτρολυτών στο διάλυμα και αναφέρεται ως εφαλάτωση και εξαλάτωση.
Εφαλάτωση (salting in ) : Η αύξηση της διαλυτότητας των βιομορίων με ταυτόχρονη αύξηση της συγκέντρωσης του ηλεκτρολύτη, σε χαμηλές συγκεντρώσεις αλατιών (<0.5 Μ) ονομάζεται εφαλάτωση, εξηγείται με τη θεωρία των Debye-Huckel και αφορά τις μη ειδικές ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των φορτίων των βιομορίων και των ιόντων που βρίσκονται στο διάλυμα. Αντίθετα, συμβαίνει μείωση της διαλυτότητας των βιομορίων όταν ελαττώνεται η συγκέντρωση ιόντων, σε χαμηλές συγκεντρώσεις αλατιών.
Εξαλάτωση (salting out) : Η ελάττωση της διαλυτότητας των βιομορίων με την αύξηση της συγκέντρωσης των ιόντων στο διάλυμα, σε πυκνά ηλεκτρολυτικά διαλύματα ονομάζεται εξαλάτωση. Τα βιομόρια συμπεριφέρονται ως ουδέτερα δίπολα και διέπονται από τον υδροφοβικό και πολικό τους χαρακτήρα. Το φαινόμενο περιγράφεται με την εξίσωση των Cohn-Green
όπου I είναι η ιοντική ισχύς και υπολογίζεται από τις συγκεντρώσεις και τα σθένη όλων των ιόντων που περιέχονται στο διάλυμα, S η διαλυτότητα ενός βιομορίου, β είναι σταθερά που εξαρτάται από το pH και την θερμοκρασία, ko η σταθερά της εξαλάτωσης και εξαρτάται από το pH.
Τα βιολογικά μακρομόρια σαν πολυμερή αμινοξικών καταλοίπων ή νουκλεοτιδίων που διπλώνονται σε τριτοταγή και τεταρτοταγή δομή κυρίως λόγω αλληλεπιδράσεων Van der Waals, διπόλου-διπόλου, δεσμών υδρογόνου (C-O.......H-N), γεφυρών S-S και περιστασιακά λόγω γεφυρών άλατος μεταξύ φορτισμένων αμινοξικών καταλοίπων (-COO-...+H3N-).
Οι υδατοδιαλυτές πρωτεΐνες διατάσσουν τις υδροφοβικές ομάδες τους προς τον πυρήνα εκθέτοντας τις υδρόφιλες ομάδες στην επιφάνεια, με αποτέλεσμα να θεωρούνται σαν πολυηλεκτρολύτες ικανοί να διαλυτοποιηθούν στο νερό (πρωτικός πολικός διαλύτης). Η σταθερότητα των μακρομορίων στο διάλυμα βασίζεται στον ανταγωνισμό μεταξύ αλληλεπιδράσεων διαλύτη-διαλελυμένης ουσίας και ενδομοριακών αλληλεπιδράσεων που οδηγούν στην απόκτηση της τεταρτοταγούς δομής. Η ισορροπία μεταξύ των αλληλεπιδράσεων που ελέγχουν την διαλυτότητα και/ή την διαμόρφωση των πρωτεϊνών στον χώρο τροποποιείται από τους παρακάτω παράγοντες :
α) θερμοκρασία: αύξηση της θερμοκρασίας ,προκαλεί αύξηση της αταξίας των διαλελυμένων μορίων αλλά επίσης επιτρέπει μακρομοριακές διευθετήσεις υψηλότερης ελεύθερης ενέργειας.
β) pH: Αλλαγές του pH επηρεάζουν τόσο τον διαλύτη όσο και την διαλελυμένη ουσία
γ) Αλάτια: δρουν με διαφόρους τρόπους:
(i) Είναι υπεύθυνα για την ιοντική ισχύ και επηρεάζουν τις μακρομοριακές ηλεκτροστατικές αλληλεπιδράσεις. Η άπωση μεταξύ ηλεκτρολυτών του ιδίου φορτίου μειώνεται.
(ii) Μπορούν να σχηματίζουν απ’ευθείας αλληλεπιδράσεις με φορτισμένα αμινοξικα κατάλοιπα (αργινίνη, λυσίνη ασπαρτικο, γλουταμικο) στην επιφάνεια των πρωτεϊνών
(iii) Δρουν με διπολικές-μονοπολικές αλληλεπιδράσεις με τις διπολικές ομάδες των μακρομορίων (πεπτιδικοί δεσμοί, αμινο, υδροξυ, καρβοξυλικές ομάδες και αμίδια) και μπορούν να οδηγήσουν .σε μερική αποδιάταξη της πρωτεΐνης).
(iv) Σχηματίζουν μη πολικές αλληλεπιδράσεις μεταξύ των υδροφοβικών καταλοίπων εκτεθειμένων στο διαλύτη και των υδροφοβικών τμημάτων των οργανικών αλατιών (σουλφονικών, καρβοξυλικών, αμμωνιακών ).
δ) Ανταγωνιστές δεσμών υδρογόνου. Μόρια όπως η ουρία, το φορμαμιδία, τα γουανιδινικά αλάτια σε υψηλές συγκεντρώσεις (>=4 Μ) ανταγωνίζονται τους δεσμούς υδρογόνου των μορίων του νερού και τους ενδομοριακούς δεσμούς υδρογόνου της πρωτεΐνης δρώντας σαν αποδιατακτικοί παράγοντες, ενώ στην αντίθετη περίπτωση σταθεροποιούν τους υδροφοβικούς δεσμούς.
ε) Οργανικοί διαλύτες : Τροποποιούν την διηλεκτρική σταθερά και έτσι προκαλούν αλλαγές σε διάφορες αλληλεπιδράσεις.
Η κρυστάλλωση πρωτεϊνών είναι βιοχημική τεχνική που αρχικά χρησιμοποιήθηκε για την απομόνωση και τον έλεγχο καθαρότητας των πρωτεϊνών, καθώς η μικροκρυσταλλικότητα των μορίων είναι ένδειξη καθαρότητάς τους. Τα τελευταία χρόνια η χρήση της κρυστάλλωσης για το σκοπό αυτόν έχει εγκαταλειφθεί καθώς οι κρύσταλλοι μπορούν να περιέχουν μέχρι και 10% άλλες προσμίξεις. Για την δομική μελέτη μορίων με ακτίνες Χ η κρυστάλλωση του μορίου αποτελεί το πρωταρχικό βήμα. Τα πρώτα περιθλασιγράμματα ακτίνων-Χ από κρυστάλλους πρωτεϊνών πάρθηκαν από κρυστάλλους πεψίνης από τους Bernal και Crowfoot (D.Hodgkin) το 1934. Οι κρύσταλλοι σχηματίστηκαν στην Ουψάλα, από ένα δείγμα που τυχαία αφέθηκε ανέπαφο για αρκετές εβδομάδες και είναι ενδεικτικό για τον τρόπο που ξεκινούσαν όλες σχεδόν οι αρχικές κρυσταλλογραφικές μελέτες. Η επιλογή των πρωτεϊνών γινόταν με βάση την διαθεσιμότητα τους και την ευκολία με την οποία μπορούσαν να κρυσταλλωθούν και όχι με βάση την βιολογική τους σημασία, καθώς το ενδιαφέρον της δομικής βιολογίας τα πρώτα εκείνα χρόνια, ήταν στην ανάπτυξη των μεθόδων ακτίνων-Χ για τη λύση δομών παρά στην μεθόδευση των διαδικασιών κρυστάλλωσης. Σήμερα με την βοήθεια των εργαλείων της βιοτεχνολογίας είναι μάλλον ευκολότερο να αποκτήσει ο ερευνητής τα απαιτούμενα ποσά πρωτεϊνών για κρυσταλλώσεις (μάλιστα σε κάποιες περιπτώσεις αρκετά mg), καθώς ο στόχος δεν ειναι μόνο η ανάπτυξη κρυστάλλων αλλά και το κατάλληλο μέγεθος αυτών. Η ένταση των περιθλωμένων ακτίνων-Χ είναι ανάλογη με τον όγκο του κρυστάλλου και αντίστροφα ανάλογη με τον όγκο της στοιχειώδους κυψελίδας που δεν είναι μικρότερος από μια πρωτεϊνική υπομονάδα. Οι ακτίνες-Χ σκεδάζονται ασθενώς από ένα μόνο μόριο, σε αντίθεση με ότι συμβαίνει μ΄ ένα κρύσταλλο που περιέχει μεγάλο αριθμό μορίων διευθετημένων κανονικά (ένας συνηθισμένος κρύσταλλος έχει περίπου 1015-1018 μόρια). Για παράδειγμα, πρωτεΐνες μοριακού βάρους μικρότερο από 50.000 Dalton που θα σχημάτιζαν κρύσταλλο 0.1mm σε όλες τις διαστάσεις, θα παρήγαγαν περιθλασίγραμμα μόνο με βασικά δεδομένα, ενώ για ανάλυση δομής σε υψηλή διακριτικότητα απαιτούνται κρύσταλλοι 0.3 mm σε όλες τις διαστάσεις με 30 φορές μεγαλύτερο όγκο.

Η δημιουργία πυρήνων κρυστάλλωσης και η αύξηση των κρυστάλλων εξαρτάται από πολλές παραμέτρους που αναφέρονται παρακάτω:
Ενδογενείς φυσικοχημικές παράμετροι
Υπερκορεσμός (συγκέντρωση πρωτεΐνης και παραγόντων κατακρήμνισης)
Θερμοκρασία, pH (μεταβολές)
Χρόνος (ρυθμοί εξισορρόπησης και αύξησης)
Ιοντική ισχύς και καθαρότητα των χημικών (φύση των παραγόντων κατακρήμνισης, ρυθμιστικά διαλύματα, επιπρόσθετες χημικές ουσίες)
Διάχυση και μεταφορά (πηκτώματα, μικροβαρύτητα)
Όγκος και γεωμετρία του δείγματος και των πειραματικών συσκευών (επιφάνεια των συσκευών κρυστάλλωσης)
Στερεά σωματίδια, αλληλεπιδράσεις με τα τοιχώματα και με τις διάμεσες επιφάνειες (ομοιογενής, ετερογενής πυρήνωση)
Φαινόμενα εξαρτημένα από την πυκνότητα ή το ιξώδες (διαφορές μεταξύ κρυστάλλου και μητρικού υγρού)
Πίεση, ηλεκτρικά και μαγνητικά πεδία
Δονήσεις και ήχος (ακουστικά κύματα)
Σειρά των γεγονότων, επαναληψιμότητα (ερευνητής ή ρομπότ)
Βιοχημικές και βιοφυσικές παράμετροι
Ευαισθησία της δομής της πρωτεΐνης σε φυσικές παραμέτρους (θερμοκρασία, pH, ιοντική ισχύς, διαλύτες .
Δέσμευση άλλων υποκαταστατών (υποστρώματα, συνπαράγοντες, μεταλλικά ιόντα, άλλα ιόντα)
Ειδικές πρόσθετες ουσίες (ανταγωνιστικές ουσίες, μη ιοντικά απορρυπαντικά, πολυαμίνες)
Ιδιότητες των πρωτεϊνών (οξείδωση, υδροφοβικότητα, υδροφιλικότητα )
Γήρανση του δείγματος (οξειδοαναγωγικές μεταβολές, αποδιάταξη, αποικοδόμηση)
Βιολογικοί παράμετροι
Πολύ μικρές ποσότητες των περισσοτέρων πρωτεϊνών στην φύση
Βιολογικές πηγές και φυσιολογική κατάσταση των οργανισμών ή των κυττάρων που περιέχουν τις πρωτεΐνες (θερμόφιλοι, ψυχρόφιλοι, αλλόφιλοι, μεσόφιλοι οργανισμοί, στατική ή αναπτυσσόμενη φάση κυττάρων)
Βακτηριακές μολύνσεις
Καθαρότητα των μακρομορίων
Μακρομοριακές επιμολύνσεις (με άλλα μακρομόρια ή άλλα μικρά μόρια)
(Μικρο)ετερογένεια της ακολουθίας (κοψίματα από πρωτεάσες ή νουκλεάσες -τα κλάσματα μακρομορίων μπορεί να κρυσταλλώνουν ευκολότερα-, μερικές ή ετερογενείς μεταφραστικές τροποποιήσεις
Δομική (μικρο)ετερογένεια (βαθμός και τρόπος πολυμερισμού συσσωματώματα, αποδιάταξη)
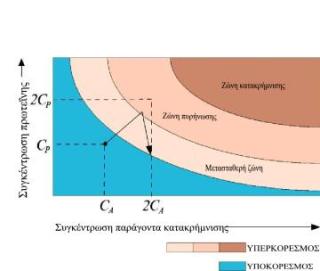
Καθώς η διαλυτότητα των πρωτεϊνών εξαρτάται από διάφορους παράγοντες, (κυριότεροι η συγκέντρωση της πρωτεΐνης, η ιοντική ισχύς, το pH, η θερμοκρασία, η φύση των διαλυτών που χρησιμοποιούνται), ένα δισδιάστατο διάγραμμα διαλυτότητας σε σχέση με μια παράμετρο είναι αντιπροσωπευτικό για κάθε βιομόριο, εφ' όσον οι άλλες παράμετροι παραμένουν σταθεροί.
 |
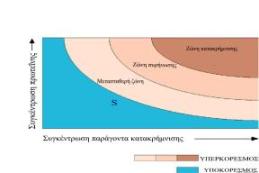 |
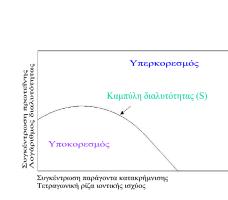
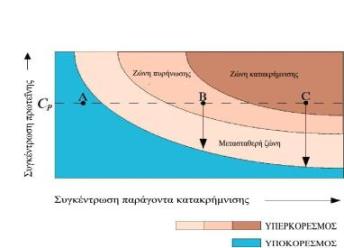
Η καμπύλη διαλυτότητας (S) ορίζει τις ζώνες υποκορεσμού και υπερκορεσμού και καθορίζει την κατάσταση εξισορρόπησης μεταξύ κορεσμένης πρωτεΐνης και κρυσταλλωμένης πρωτεΐνης στο διάλυμα Κάτω από την καμπύλη κορεσμού η πρωτεΐνη δεν πρόκειται ποτέ να κρυσταλλωθεί (υποκορεσμός), ενώ πάνω από την καμπύλη διαλυτότητας η συγκέντρωση της πρωτεΐνης είναι υψηλότερη από την συγκέντρωση εξισορρόπησης για δεδομένη συγκέντρωση ηλεκτρολύτη (υπερκορεσμός) και υποδιαιρείται σε τρεις άλλες ζώνες:
Ζώνη κατακρήμνισης: η πρωτεΐνη μετατρέπεται σε άμορφη μάζα.
Ζώνη πυρήνωσης (πυρήνες κρυστάλλωσης)
Πυρήνες κρυστάλλωσης ονομάζονται οι πιο μικρές οργανωμένες μορφές πρωτεϊνικών συσσωματωμάτων και σχηματίζονται στην περιοχή όπου η περίσσεια της πρωτεΐνης παίρνει κρυσταλλική μορφή. Κοντά στην ζώνη κατακρήμνισης βρίσκεται πλήθος μικροκρυστάλλων οι οποίοι μπορούν να μπερδευτούν με το άμορφο ίζημα πρωτεΐνης. Η εύρεση της ζώνης πυρήνωσης αποτελεί πρωταρχικό σκοπό των πειραμάτων κρυστάλλωσης.
Μετασταθερή ζώνη (αύξηση κρυστάλλων): ένα υπέρκορο διάλυμα πρωτεΐνης μπορεί να μην δημιουργεί πυρήνες κρυστάλλωσης για μακρύ χρονικό διάστημα, εκτός αν βοηθηθεί μηχανικά. Η ζώνη αυτή αντιστοιχεί ιδανικά στην αύξηση κρυστάλλων από πυρήνες κρυστάλλωσης που προϋπάρχουν χωρίς την δημιουργία νέων.
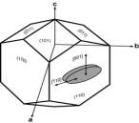
Κρύσταλλος είναι η κανονική, επαναλαμβανόμενη διευθέτηση ατόμων ή μορίων σε τρεις διαστάσεις. Αποτελείται από όμοιες κυψελίδες που έχουν τον ίδιο προσανατολισμό και επαναλαμβάνονται στις τρεις διαστάσεις, ώστε να δημιουργούν ένα κανονικό τρισδιάστατο πλέγμα. Η μονάδα όγκου του πλέγματος με πλευρές a, b, c ονομάζεται στοιχειώδης κυψελίδα, μπορεί να επιλεγεί με διαφόρους τρόπους και περιορίζονται να έχουν σχήματα τα οποία επαναλαμβανόμενα με μετατόπιση να μην αφήνουν κενά. Στην απλούστερη περίπτωση η στοιχειώδης κυψελίδα περιέχει ένα μόνο μόριο, συνήθως όμως αποτελείται από δύο ή περισσότερα μόρια συνδεόμενα με κάποιο είδος συμμετρικής διευθέτησης, έτσι ώστε να συμπληρώνουν τον χώρο πιο ικανοποιητικά παρά αν ήταν το καθένα μόνο του.
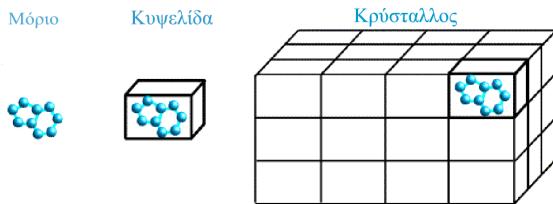
Οι αλληλεπιδράσεις που κρατούν τις πρωτεΐνες στο κρυσταλλικό πλέγμα ονομάζονται κρυσταλλικές επαφές και είναι ίδιες σε κάθε οργανωμένη βασική μονάδα μορίων που περιέχεται στην στοιχειώδη κυψελίδα του κρυσταλλικού πλέγματος.
Απαιτείται η μεγαλύτερη δυνατή καθαρότητα των πρωτεϊνών για τα πειράματα κρυστάλλωσης, καθώς η ανομοιογένεια λόγω βιοχημικών τροποποιήσεων (πρωτεόλυση, φωσφορυλίωση, γλυκοζυλίωση) ή άλλων παραγόντων οδηγεί τις πρωτεΐνες να μην κρυσταλλώνουν ή να κρυσταλλώνουν δύσκολα.

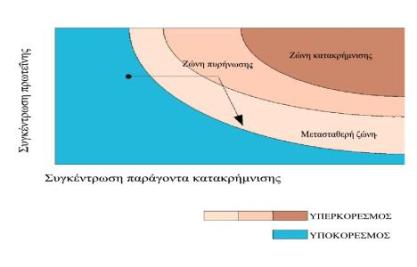
Για την κρυσταλλογραφική μελέτη μίας πρωτεΐνης απαιτούνται μεγάλοι και καλοσχηματισμένοι κρύσταλλοι, γι αυτό σε πρώτη φάση πρέπει να δημιουργηθούν πυρήνες κρυστάλλωσης και να αφεθούν στην μετασταθερή ζώνη για να μεγαλώσουν. Αυτό προϋποθέτει ότι η πρωτεΐνη θα υπερβεί ένα φράγμα ενέργειας προκειμένου να μπορέσει να κρυσταλλώσει, ανάλογο με αυτό των τυπικών χημικών αντιδράσεων, όπως φαίνεται στο παρακάτω σχήμα:
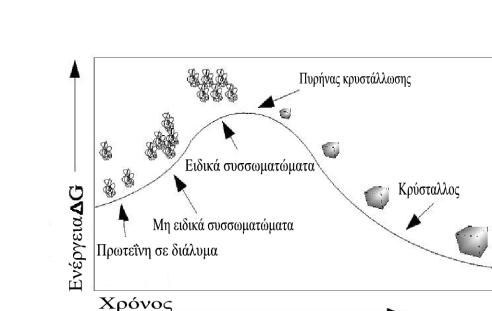
Δηλαδή το διάλυμα της πρωτεΐνης πρέπει να περάσει από την διαλυτή φάση στην ζώνη πυρήνωσης και να παραμείνει εκεί για σύντομο χρονικό διάστημα έτσι ώστε να μην δημιουργηθούν πολλοί πυρήνες κρυστάλλωσης που οδηγούν σε πολλούς και μικρότερου όγκου κρυστάλλους. (Η αύξηση του όγκου των κρυστάλλων σε διάλυμα με πολλούς πυρήνες κρυστάλλωσης οδηγεί σε επικαλύψεις κρυσταλλικών πλεγμάτων, άρα σε κακοσχηματισμένους κρυστάλλους). Στην συνέχεια, το πρωτεϊνικό διάλυμα όταν μεταπέσει στην μετασταθερή ζώνη, οι πυρήνες θα συνεχίσουν να μεγαλώνουν και θα δώσουν καλοσχηματισμένους κρυστάλλους. Όσο οι κρύσταλλοι μεγαλώνουν τόσο η συγκέντρωση της διαλελυμένης πρωτεΐνης μικραίνει, με αποτέλεσμα η μετασταθερή ζώνη να μετατοπίζεται. Έτσι κυριότερο μέλημα στα πειράματα κρυστάλλωσης είναι η δημιουργία συνθηκών συνεχούς παρακολούθησης της μετασταθερής ζώνης.
Από τα παραπάνω στοιχεία προκύπτει ότι ο τρόπος ελάττωσης της διαλυτότητας της πρωτεΐνης στο διάλυμα. πρέπει να είναι ελεγχόμενος Ταχεία ελάττωση της διαλυτότητας οδηγεί σε άμορφα ιζήματα, γι αυτό η προσέγγιση του σημείου υπερκορεσμού γίνεται αργά, αλλάζοντας βαθμιαία παράγοντες όπως η συγκέντρωση, η ιοντική ισχύς, το pH, ή η διηλεκτρική σταθερά του πρωτεϊνικού διαλύματος.
Συγκέντρωση πρωτεΐνης: πολλές πρωτεΐνες έχουν κρυσταλλωθεί από διαλύματα που περιέχουν ένα έως εκατοντάδες mg/ml πρωτεΐνης. Ωστόσο για πειραματικές δοκιμές είναι επιθυμητή συγκέντρωση 10-20 mg/ml, εάν αυτό είναι δυνατόν.
Ιοντική ισχύς: η ιοντική ατμόσφαιρα μεταβάλλει την διαλυτότητα των πρωτεϊνών μέσω των φαινομένων:
Salting in: οι πρωτεΐνες είναι πιο διαλυτές παρουσία μικρής ποσότητας ηλεκτρολύτη παρά σε καθαρό νερό καθώς τα ιόντα του ηλεκτρολύτη δεσμεύονται στην επιφάνεια της πρωτεΐνης και αυξάνουν την υδροφιλικότητά της. Σ' αυτή την περίπτωση η πρωτεΐνη μπορεί να κρυσταλλωθεί ελαττώνοντας την συγκέντρωση του ηλεκτρολύτη (άλατος).
Salting out: εάν ένας ισχυρός ηλεκτρολύτης (πχ θειικό αμμώνιο) προστεθεί στο διάλυμα της πρωτεΐνης, (όπου η διαλυτότητά του ειναι μεγαλύτερη από αυτήν της πρωτεΐνης), αυξάνεται ο ανταγωνισμός των ιόντων για τα μόρια του νερού τόσο μεταξύ τους όσο και με τα μόρια της πρωτεΐνης και έτσι απομακρύνονται μόρια νερού από το διάλυμα της πρωτεΐνης με αποτέλεσμα να μειώνεται η διαλυτότητά της.
pH: Το καθαρό φορτίο της πρωτεΐνης μπορεί να μεταβληθεί με την μεταβολή των πρωτονίων, αλλάζοντας το pH ή με την δέσμευση ιόντων σε πολικές ομάδες της πρωτεΐνης. Όσο μεγαλύτερο καθαρό φορτίο έχει η πρωτεΐνη τόσο πιο ευδιάλυτη είναι, ενώ όταν έχει καθαρό φορτίο μηδέν βρίσκεται στο σημείο ελάχιστης διαλυτότητας. Αυτό συμβαίνει όταν η πρωτεΐνη βρίσκεται στο ισοηλεκτρικό της σημείο (pI). Το pH είναι πολύ σημαντικός παράγοντας για την κρυστάλλωση και απαιτεί την χρήση κατάλληλων ρυθμιστικών διαλυμάτων.
Θερμοκρασία: η διαλυτότητα της πρωτεΐνης έχει άμεση εξάρτηση από την θερμοκρασία, αλλά ποικίλει σημαντικά από πρωτεΐνη σε πρωτεΐνη σε συνδυασμό με την ιοντική ισχύ, την παρουσία οργανικών διαλυτών και τις ειδικότερες πειραματικές συνθήκες. Οι δοκιμασίες γίνονται σε θερμοκρασία ψυγείου (4-6 oC ) είτε σε σταθερή θερμοκρασία δωματίου (17-24 oC).
Οργανικοί–μη πολικοί διαλύτες: διαλύματα που χρησιμοπιούνται είναι η αιθανόλη ή η πεντανοδιόλη σε ανάμειξη με υδατικό διάλυμα και ελαττώνουν την διαλυτότητα της πρωτεΐνης. Δεσμεύονται σε πολικές ομάδες της επιφάνειας της πρωτεΐνης, έτσι ώστε να φαίνεται λιγότερο πολική, ή απλώς ελαττώνουν τον αποτελεσματικό αριθμό πολικών ομάδων του διαλύτη.
Είναι η κλασσική τεχνική που χρησιμοποιήθηκε για κρυστάλλωση ενζύμων.(επιτυχής παραγωγή μεγάλων κρυστάλλων λυσοζύμης, ριβονουκλεάσης και ένζυμα της οικογένειας των θρυψινών). Η πρωτεΐνη διαλύεται σε χαμηλή ιοντική ισχύ για να δώσει διάλυμα υψηλής συγκέντρωσης. Ο παράγοντας κατακρήμνισης (αλάτι ή οργανικός διαλύτης) προστίθεται στην συνέχεια έτσι ώστε να φέρει το διάλυμα σε κατάσταση υπερκορεσμού. Αφού παραμείνει για ώρες ή μέρες εμφανίζονται οι κρύσταλλοι. Όταν οι συνθήκες υπερκορεσμού δεν είναι γνωστές, ο παράγοντας κατακρήμνισης προστίθεται σε μικρές ποσότητες μέρα με την μέρα.
Μειονέκτημα της μεθόδου είναι η μικρή δυνατότητα ελέγχου της ανάπτυξης των κρυστάλλων και η απαίτηση μεγάλων ποσοτήτων πρωτεΐνης, είναι όμως χρήσιμη για πρωτεΐνες των οποίων ο ταχύτητες σχηματισμού πυρήνων και ανάπτυξης κρυστάλλων είναι χαμηλές όταν επιτευχθεί υπερκορεσμός, ή για εκείνες που δίνουν καλά σχηματισμένους κρυστάλλους ακόμα και σε υψηλούς ρυθμούς ανάπτυξης.
Κλασσική μέθοδος για την κρυστάλλωση μικρότερων μορίων είναι η επίδραση στην αύξηση της συγκέντρωσης του διαλύματος με την εξάτμιση του διαλύτη, αλλά δεν είναι κατάλληλη για πρωτεΐνες καθώς δεν ελέγχεται και προκαλεί κρυστάλλωση των αλάτων. Πιο ευαίσθητη τεχνική είναι ο έλεγχος της εξάτμισης με εξισορρόπηση από ένα πιο συγκεντρωμένο διάλυμα άλατος. Έτσι ένα διάλυμα πρωτεΐνης με συγκέντρωση άλατος 10% μικρότερη από αυτή που απαιτείται για κατακρήμνιση εξισορροπείται με διάχυση ατμών από ένα μεγάλο όγκο διαλύματος άλατος μεγαλύτερης συγκέντρωσης. Τα δύο διαλύματα βρίσκονται σε ανοιχτά δοχεία μέσα σε ένα μεγαλύτερο καλά κλεισμένο δοχείο. Το διάλυμα μεταφέρεται σταδιακά μέσω της φάσης των ατμών από το πρωτεϊνικό διάλυμα στο πιο συγκεντρωμένο διάλυμα άλατος έως ότου επέλθει ισορροπία και οι κρύσταλλοι σχηματίζονται καθώς το πρωτεϊνικό διάλυμα αποκτά μεγαλύτερη συγκέντρωση.
Εναλλακτική μέθοδος διάχυσης των ατμών είναι αυτή της 'κρεμάμενης σταγόνας' (hanging drop). Η αρχή της μεθόδου είναι η ίδια και ο τρόπος εκτέλεσης αναφέρεται στο πρακτικό μέρος. Πλεονεκτήματα της μεθόδου είναι η μικρές ποσότητες πρωτεινης που απαιτούνται, η εύκολη παρακολούθηση της πορείας κρυστάλλωσης, η απλότητα και το χαμηλό κόστος. Ειναι ευρέως διαδεδομένη και ιδιαίτερα αποτελεσματική στην παραγωγή κρυστάλλων.
Μια μεμβράνη διαπίδυσης είναι ένα ημιπερατό διάφραγμα που επιτρέπει στον διαλύτη και σε μικρά ιόντα να εξισορροπηθούν, αλλά δεν διαπερνάται από τα μόρια της πρωτεΐνης. Παράγονται από σελοφάν ή κυτταρίνη και έχουν πόρους διαφορετικών διαστάσεων, που κάθε φορά επιλέγονται με κριτήριο το μέγεθος της πρωτεΐνης που θα διαχωριστεί. Η ιοντική ισχύς και το pH του πρωτεϊνικού διαλύματος που περιέχεται σε μια τέτοια μεμβράνη ρυθμίζεται με εξισορρόπηση έναντι του ελεύθερου πρωτεΐνης διαλύματος.
Όταν ο όγκος της διαθέσιμης πρωτεΐνης ειναι μεγάλος π.χ 1ml, τότε μπορεί να τοποθετηθεί σε σάκο από μεμβράνη διαπίδυσης και να βυθιστεί σε κατάλληλο ρυθμιστικό διάλυμα. Η κατάσταση υπερκορεσμού προσεγγίζεται αργά μεταβάλλοντας βαθμιαία τις συνθήκες του εξωτερικού ρυθμιστικού διαλύματος, έτσι ώστε ο σχηματισμός πυρήνων και η ανάπτυξη να μπορεί να ρυθμιστεί μέσω διάχυσης. Άμορφα ιζήματα ή μικροκρύσταλλοι μπορούν να επαναδιαλυτοποιηθούν με αλλαγή των εξωτερικών συνθηκών και να επαναληφθεί η δοκιμασία, (όπως φαίνεται στο παρακάτω διάγραμμα διαλυτότητας)
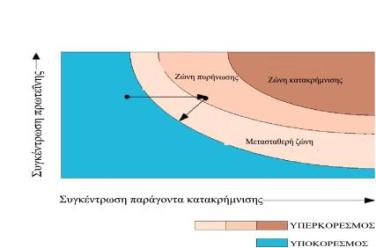
Η μέθοδος μπορεί να προσαρμοστεί για χρήση με μικρές ποσότητες πρωτεΐνης (microdialysis technique). Στην τεχνική της μικροδιαπίδυσης χρησιμοποιείται τριχοειδής σωλήνας αντί του σάκου, μέσα στον οποίο τοποθετείται το διάλυμα της πρωτεΐνης και το ελεύθερο άκρο του καλύπτεται από μικρό κομμάτι μεμβράνης διαπίδυσης. Μειονεκτήματα της μεθόδου είναι η δυσχερής παρατήρηση των κρυστάλλων που σχηματίζονται πάνω στην μεμβράνη και η δυσκολία απομάκρυνσης των κρυστάλλων όταν ο τριχοειδής σωλήνας έχει μικρή διάμετρο.
Σε κάθε ομάδα αντιστοιχούν 6 σωληνάκια, ένα για κάθε άτομο της ομάδας, parafilm και φελιζόλ όπου θα στηριχθούν τα σωληνάκια.
Κάθε ομάδα θα χρησιμοποιήσει μια ορισμένη αρχική αλατότητα (% NaCl) και το κάθε άτομο ένα ορισμένο pH, όπως φαίνεται στον παρακάτω πίνακα